多囊卵巢综合征(PCOS)是青春期和育龄期女性常见的一种复杂的多系统综合征,按NICHD/NIH的诊断标准,PCOS的发病率占生育年龄女性的4%~10%[1,2,3]。PCOS主要表现为稀发排卵/无排卵,多囊卵巢以及高雄激素血症,且多伴有肥胖、胰岛素抵抗、糖耐量受损、脂代谢紊乱等代谢异常[4,5],其中肥胖的发生率约为50%~80%[4]。肥胖的患者存在脂肪因子分泌异常,血清游离脂肪酸(FFAs)升高,脂肪组织中类固醇激素代谢异常等一系列脂肪功能紊乱的表现,进而导致低度的代谢性炎症、胰岛素抵抗以及糖耐量受损[4,6]。约20%肥胖的PCOS患者存在糖耐量受损或2型糖尿病[7]。此外,与非PCOS患者相比,非肥胖的PCOS患者罹患糖耐量受损和2型糖尿病的风险也显著升增加[5]。约44%~70% PCOS患者存在胰岛素抵抗[4,8,9],由于胰岛素介导的抑制脂解和脂质氧化作用受损[10,11],其血清FFAs水平升高[12]。
高雄激素血症是PCOS的另一个核心病理生理改变。雄激素促进内脏脂肪细胞脂质分解可能是PCOS早期主要的代谢异常[13,14],然而,高胰岛素血症和高雄激素血症对磷脂代谢、FFAs谱以及多不饱和脂肪酸(PUFAs)的代谢仍缺乏系统的研究。其中,由花生四烯酸(AA)经环氧化酶(COX)途径生成的一系列前列腺素(PGs)除了是重要的炎症介质,在生殖调节中也起关键作用。如COX基因敲除后卵母细胞的成熟受到影响,不能正常排卵和受精[15,16,17];COX抑制剂可以阻断胚泡发育,表明COX及其代谢产物参与胚胎的早期发育[18]。此外,研究显示:PGE2、PGI2、PGF2a、PGD2和15d-PGJ2在卵泡发育、排卵和受精过程中也都有重要作用[19,20,21,22,23]。但是,目前尚未见在同一批PCOS患者中,同时完整地测定磷脂、FFA的量和组分变化、以及PUFAs代谢的改变,而其机制更有待进一步探索。
作为代谢组学的一个分支,脂质组学已成为研究人类疾病中脂质代谢不可或缺的工具。鉴于脂质及其代谢产物在PCOS代谢和生殖中的广泛作用,我们选取了PCOS专病门诊中的初诊患者,利用脂质组学进行了脂质谱的测定,以更好地了解PCOS脂质代谢的概貌,为阐明PCOS的发病机制和治疗手段提供新的视角。
上海交通大学医学院附属仁济医院内分泌科门诊收集的32例初诊PCOS患者,PCOS诊断标准根据2003年鹿特丹会议诊断标准[24],并且排除先天性肾上腺皮质增生、分泌雄激素的肿瘤、库欣综合征、甲状腺功能紊乱、促性腺激素减退和卵巢早衰、高催乳素血症等疾病。同时收集年龄和体重指数(BMI)匹配的正常育龄妇女34例作为对照,分为4组:非肥胖对照组(LC组,BMI<24 kg/m2,n=18)、肥胖对照组(OB组,BMI≥28 kg/m2,n=16)、非肥胖PCOS组(LP组,BMI<24 kg/m2,n=17)以及肥胖PCOS组(OP组,BMI≥28 kg/m2,n=15)。所有入组对象排除:有心肝肾等重要脏器疾病者,服用影响脂代谢药物的(如避孕药、糖皮质激素等),以及吸烟和酗酒者。
1. 每个受试者空腹10 h以上,次日凌晨8∶00采空腹静脉血,测血糖、胰岛素、血脂等生化指标。安排月经规律者,于月经第2~4天采清晨8∶00空腹血,测定性激素和性激素结合球蛋白。除总睾酮在中科院营养所用LC-MS测定外,以上指标均由仁济医院检验科完成。
2. 专人测量身高、体重,计算BMI。稳态模型评估的胰岛素抵抗指数(HOMA-IR)=空腹血糖(FPG)×空腹胰岛素(FINS)/22.5。游离睾酮指数(FAI)=总睾酮(TT)/性激素结合球蛋白(SHBG)×100。脂肪肝由B超室专科医生进行评估。
3. 磷脂谱、游离脂肪酸谱、多不饱和脂肪酸代谢谱用GC-MS和LC-MS测定,由中科院营养所尹慧勇课题组完成。
采用SPSS 16.0软件包进行数据分析处理。统计学描述计量资料采用 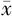 ±s 或
±s 或 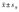 ,计数资料采用率表示。对不符合正态分布的数据进行对数转化后再进行分析。多组间比较采用单因素方差分析(one-way ANOVA);率的比较用卡方检验。对非正态分布的资料采用Mann-Whitney U检验;以P<0.05认为具有统计学差异。
,计数资料采用率表示。对不符合正态分布的数据进行对数转化后再进行分析。多组间比较采用单因素方差分析(one-way ANOVA);率的比较用卡方检验。对非正态分布的资料采用Mann-Whitney U检验;以P<0.05认为具有统计学差异。
如表1所示,LP组年龄低于LC组和OB组,其他组间均未见差异。OP组胰岛素抵抗最严重,相应的SHBG显著低于其他3组。正如预期的,PCOS组睾酮和DHEAS显著高于非PCOS患者,但PCOS组内(OP对LP)未见差异。由于OP组SHBG的显著下降,该组FAI显著高于其他3组。血脂的结果也显示OP组存在更严重的脂代谢紊乱(高TG、TC、LDL-C,和低HDL-C)。非酒精性脂肪性肝病(NAFLD)的比例,OP组显著高于其他3组;其中,OB组的发生率也高于LC组。
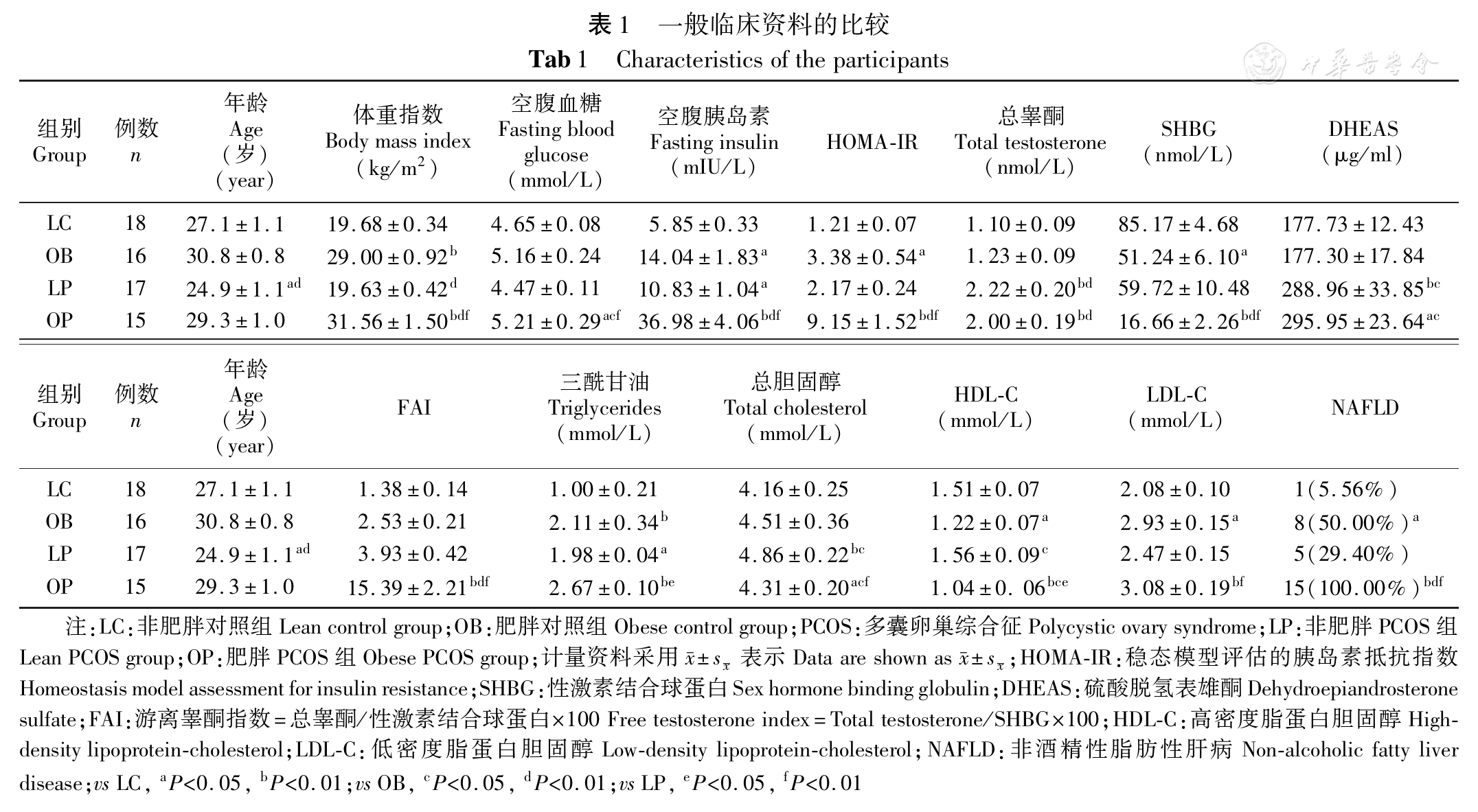 | 表1 一般临床资料的比较 Tab 1 Characteristics of the participants |
一般临床资料的比较
Characteristics of the participants
| 组别Group | 例数n | 年龄Age(岁)(year) | 体重指数Body mass index(kg/m2) | 空腹血糖Fasting bloodglucose(mmol/L) | 空腹胰岛素Fasting insulin(mIU/L) | HOMA-IR | 总睾酮Total testosterone(nmol/L) | SHBG(nmol/L) | DHEAS(μg/ml) |
|---|---|---|---|---|---|---|---|---|---|
| LC | 18 | 27.1±1.1 | 19.68±0.34 | 4.65±0.08 | 5.85±0.33 | 1.21±0.07 | 1.10±0.09 | 85.17±4.68 | 177.73±12.43 |
| OB | 16 | 30.8±0.8 | 29.00±0.92b | 5.16±0.24 | 14.04±1.83a | 3.38±0.54a | 1.23±0.09 | 51.24±6.10a | 177.30±17.84 |
| LP | 17 | 24.9±1.1ad | 19.63±0.42d | 4.47±0.11 | 10.83±1.04a | 2.17±0.24 | 2.22±0.20bd | 59.72±10.48 | 288.96±33.85bc |
| OP | 15 | 29.3±1.0 | 31.56±1.50bdf | 5.21±0.29acf | 36.98±4.06bdf | 9.15±1.52bdf | 2.00±0.19bd | 16.66±2.26bdf | 295.95±23.64ac |
| 组别Group | 例数n | 年龄Age(岁)(year) | FAI | 三酰甘油Triglycerides(mmol/L) | 总胆固醇Total cholesterol(mmol/L) | HDL-C(mmol/L) | LDL-C(mmol/L) | NAFLD |
|---|---|---|---|---|---|---|---|---|
| LC | 18 | 27.1±1.1 | 1.38±0.14 | 1.00±0.21 | 4.16±0.25 | 1.51±0.07 | 2.08±0.10 | 1(5.56%) |
| OB | 16 | 30.8±0.8 | 2.53±0.21 | 2.11±0.34b | 4.51±0.36 | 1.22±0.07a | 2.93±0.15a | 8(50.00%)a |
| LP | 17 | 24.9±1.1ad | 3.93±0.42 | 1.98±0.04a | 4.86±0.22bc | 1.56±0.09c | 2.47±0.15 | 5(29.40%) |
| OP | 15 | 29.3±1.0 | 15.39±2.21bdf | 2.67±0.10be | 4.31±0.20acf | 1.04±0. 06bce | 3.08±0.19bf | 15(100.00%)bdf |
注:LC:非肥胖对照组Lean control group;OB:肥胖对照组Obese control group;PCOS:多囊卵巢综合征Polycystic ovary syndrome;LP:非肥胖PCOS组Lean PCOS group;OP:肥胖PCOS组Obese PCOS group;计量资料采用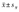 表示Data are shown as
表示Data are shown as  ;HOMA-IR:稳态模型评估的胰岛素抵抗指数Homeostasis model assessment for insulin resistance;SHBG:性激素结合球蛋白Sex hormone binding globulin;DHEAS:硫酸脱氢表雄酮Dehydroepiandrosterone sulfate;FAI:游离睾酮指数=总睾酮/性激素结合球蛋白×100 Free testosterone index=Total testosterone/SHBG×100;HDL-C:高密度脂蛋白胆固醇High-density lipoprotein-cholesterol;LDL-C:低密度脂蛋白胆固醇Low-density lipoprotein-cholesterol;NAFLD:非酒精性脂肪性肝病Non-alcoholic fatty liver disease;vs LC, aP<0.05, bP<0.01;vs OB, cP<0.05, dP<0.01;vs LP, eP<0.05, fP<0.01
;HOMA-IR:稳态模型评估的胰岛素抵抗指数Homeostasis model assessment for insulin resistance;SHBG:性激素结合球蛋白Sex hormone binding globulin;DHEAS:硫酸脱氢表雄酮Dehydroepiandrosterone sulfate;FAI:游离睾酮指数=总睾酮/性激素结合球蛋白×100 Free testosterone index=Total testosterone/SHBG×100;HDL-C:高密度脂蛋白胆固醇High-density lipoprotein-cholesterol;LDL-C:低密度脂蛋白胆固醇Low-density lipoprotein-cholesterol;NAFLD:非酒精性脂肪性肝病Non-alcoholic fatty liver disease;vs LC, aP<0.05, bP<0.01;vs OB, cP<0.05, dP<0.01;vs LP, eP<0.05, fP<0.01
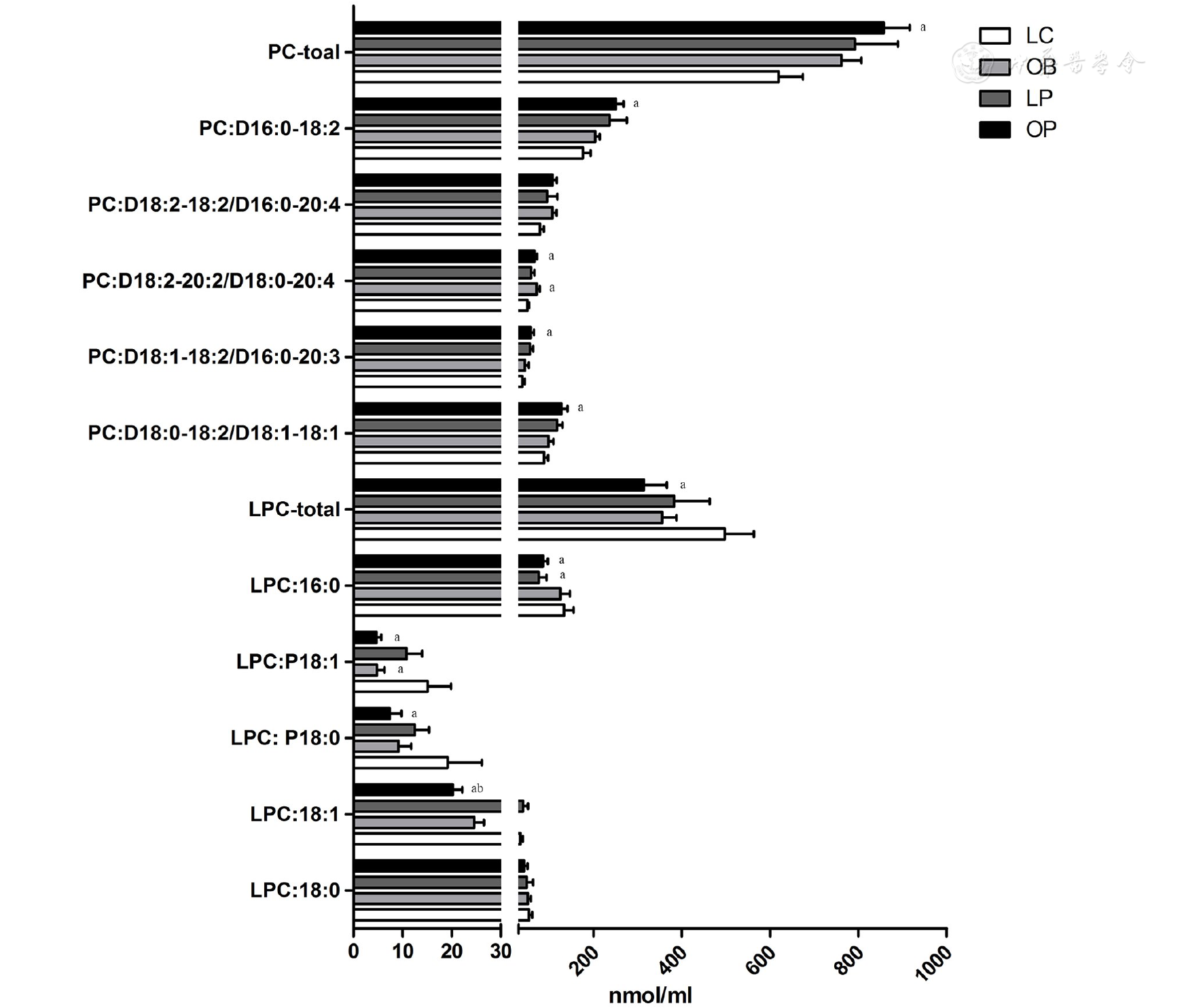
如图1所示,LC组、OB组、LP组和OP组的PC浓度依次递增,且OP组与LC组间有统计学差异;OB组、LP组及OP组LPC浓度均低于LC组,且OP组与LC组有统计学差异。从LPC的亚类看,LPC 16∶0,P18∶0,P18∶1,18∶1的浓度OP组显著低于LC组,差异具有显著性;其中LP组LPC 16∶0也显著低于LC组,OB组LPC P18∶1显著低于LC组。OP与LP组间,只有LP组LPC 18∶1高于OP组,且P<0.05。与之相应的是,PC sn-1为16∶0、18∶0和18∶1,sn-2为18∶2和20∶4的亚类,OP组显著高于LC组。OP组与LP组间未见差异。

注:LC:非肥胖对照组Lean control group;OB:肥胖对照组Obese control group;PCOS:多囊卵巢综合征Polycystic ovary syndrome;LP:非肥胖PCOS组Lean PCOS group;OP:肥胖PCOS组Obese PCOS group;计量资料采用 表示Data are shown as
表示Data are shown as  ;PC:D16∶0-18∶2:磷脂酰胆碱,sn-1位为棕榈酸,sn-2位为亚油酸1-palmitoyl-sn-2-linoleic-sn-glycero-3-phosphocholine;LPC:16∶0:溶血磷脂酰胆碱,sn-1位为棕榈酸1-palmitoyl-sn-glycero-3- phosphocholine;vs LC, aP<0.05;vs LP, bP<0.05
;PC:D16∶0-18∶2:磷脂酰胆碱,sn-1位为棕榈酸,sn-2位为亚油酸1-palmitoyl-sn-2-linoleic-sn-glycero-3-phosphocholine;LPC:16∶0:溶血磷脂酰胆碱,sn-1位为棕榈酸1-palmitoyl-sn-glycero-3- phosphocholine;vs LC, aP<0.05;vs LP, bP<0.05
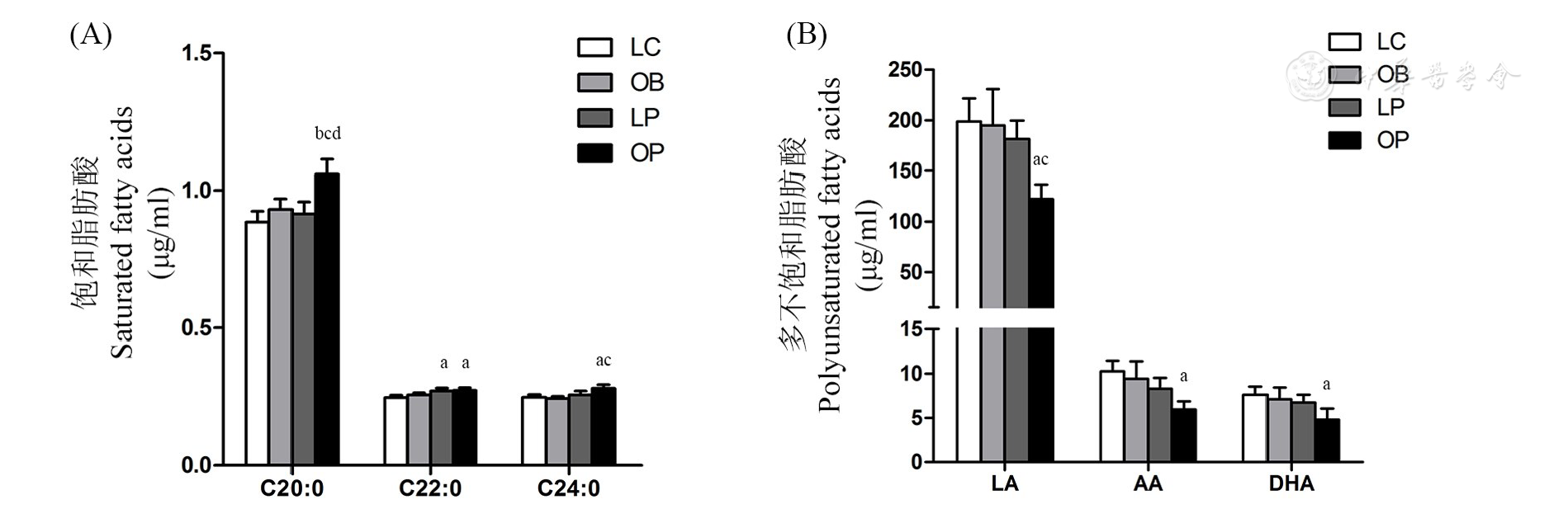
如图2A所示,极长链饱和脂肪酸(C20∶0、C22∶0和C:24∶0)LC组和OB组间均未见差异。OP组显著高于LC组,且OP组C20∶0和C:24∶0高于OB组,OP组C20∶0高于LP组,差异均达统计学意义。如图2B所示,PUFAs(C18∶2、C20∶4和C:22∶6)OP组低于其他3组,其中和LC组比较,差异具有统计学意义。

注:LC:非肥胖对照组Lean control group;OB:肥胖对照组Obese control group;PCOS:多囊卵巢综合征Polycystic ovary syndrome;LP:非肥胖PCOS组Lean PCOS group;OP:肥胖PCOS组Obese PCOS group;计量资料采用 表示Data are shown as
表示Data are shown as  ;vs LC, aP<0.05, bP<0.01;vs OB, cP<0.05;vs LP, dP<0.05
;vs LC, aP<0.05, bP<0.01;vs OB, cP<0.05;vs LP, dP<0.05
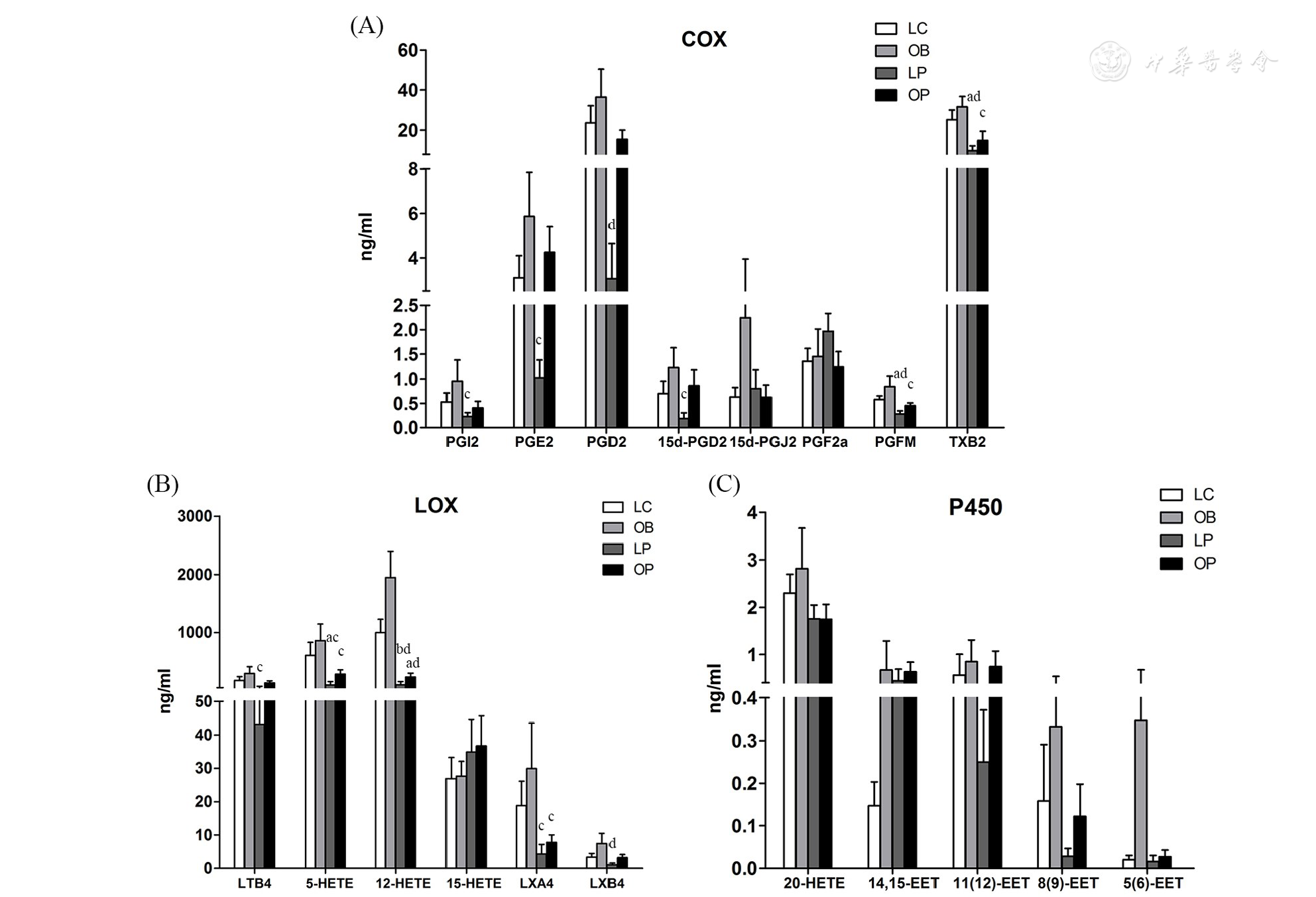
花生四烯酸COX代谢产物PGE2、PGI2、PGD2、15d-PGD2、PGFM和TXB2的水平OB组最高,而LP组最低,其中LP组和OB组间差异具有统计学意义。其中15d-PGD2、TXB2的水平OP组也显著低于LC组(P<0.05,图3A)。花生四烯酸LOX代谢产物中,除了15-羟基二十碳四烯酸(15-HETE)以外,变化规律基本和COX通路一致,OB>CON>OP>LP组,LP组显著低于OB组(P<0.05);其中,LP组的5-HETE和12-HETE显著低于LC组;OP组的5-HETE、12-HETE和脂氧素A4(LXA4)和OB相比也显著下降(P<0.05,图3B)。花生四烯酸P450表氧途径的代谢产物中,数据变异大,相对于COX和LOX代谢途径,未见一致的变化趋势,4组间也未见显著差异(图3C)。

注:LC:非肥胖对照组Lean control group;OB:肥胖对照组Obese control group;PCOS:多囊卵巢综合征Polycystic ovary syndrome;LP:非肥胖PCOS组Lean PCOS group;OP:肥胖PCOS组Obese PCOS group;计量资料采用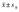 表示Data are shown as
表示Data are shown as 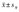 ;vs LC, aP<0.05, bP<0.01;vs OB, cP<0.05, dP<0.01
;vs LC, aP<0.05, bP<0.01;vs OB, cP<0.05, dP<0.01
多囊卵巢综合征是一个复杂的、具有很强临床异质性的疾病。PCOS患者患2型糖尿病和心血管疾病的风险也增加。大量的研究表明,PCOS和肥胖均存在慢性低滴度炎症,并参与胰岛素抵抗的发生发展[25]。除了胰岛素抵抗和代偿性的高胰岛素血症外,高雄激素是PCOS另一个核心病理生理改变。然而,这二者与PCOS患者血清脂质谱变化间的关系未见报道。本研究用LC-MS和GC-MS的方法,率先发现肥胖和非肥胖的PCOS患者间,以及各自和BMI匹配的对照间,血清磷脂代谢、游离脂肪酸谱和花生四烯酸代谢谱存在显著差异。
磷脂是细胞膜的主要成分,磷脂组分的改变会影响细胞的功能。磷脂酰胆碱(PC)是含量最丰富的膜磷脂,水解可产生溶血磷脂酰胆碱(LPC)和游离脂肪酸。在对肝炎或肝损伤患者的研究中发现,药物性肝损、病毒性肝炎、酒精性肝硬化和急性肝衰竭的患者中,LPC的水平下降[26,27]。此外,研究发现非酒精性脂肪性肝炎(NASH)患者中,LPC的水平也有下降[28,29]。在本研究中,OP组的患者几乎都伴有脂肪肝。因此,OP组中血清LPC的下降可能与脂肪肝的比例高有关。脂肪肝的动物模型发现小鼠血清中LPC (C16∶0、C18∶0、C18∶1)显著下降[30],也支持我们的发现。血清中AA主要来源于磷脂sn-2位的水解[31]。因此,在OP组中AA水平的下降可能部分源于PC / LPC代谢的异常。
对游离脂肪酸谱的研究发现,OP组PUFAs下降,而极长链饱和脂肪酸显著升高。通常PUFAs具有一定的抗炎作用,尤其是omega-3脂肪酸。而极长链饱和脂肪酸由于不能直接进入线粒体进行β氧化,要先经过氧化酶体氧化为较短链脂肪酸。第一步反应以FAD为辅基,脱下的氢不由呼吸链产生ATP,而经过氧化氢酶分解,生成过氧化氢,造成体内氧自由基增加,容易导致氧化应激、炎症,损害细胞膜功能等。本研究所示的游离脂肪酸谱的变化为OP组患者存在代谢性炎症提供了新的可能机制。
AA的活性代谢产物,特别是2系前列腺素在炎症和生殖中均有重要作用。由于血清AA低于OP组,我们进一步测定了AA的代谢产物谱,发现产物的浓度具有相似的变化趋势:OB>LC>OP>LP。最显着的差异在OB和LP组间。分析临床数据,OB组具有显著的胰岛素抵抗/高胰岛素血症,而高雄激素血症不明显;LP组有显著的高雄激素血症,而胰岛素抵抗较轻;OP组的患者兼有高胰岛素血症和高雄激素血症。根据AA代谢产物4组之间的差异,我们推测,胰岛素能上调COX,LOX活性和(或)表达,而雄激素则下调其表达和(或)活性。因此,OB组代谢产物最高,LP组最低,而OP组兼有胰岛素抵抗和高雄激素血症,故其代谢产物的水平居于2组之间。此外,OP组空腹胰岛素水平显著高于其他组,即使在这样高浓度的胰岛素存在的情况下,升高的雄激素仍然能够显着降低PGs等这些活性脂质产物的生成。OP组中有些代谢物的水平接近,甚至低于对照组,表明雄激素可以缓解甚至逆转胰岛素的这种刺激作用。另外,高胰岛素血症可降低SHBG水平,导致FAI升高,从而放大雄激素的效应,也是需要考虑的因素之一。胰岛素和雄激素对AA代谢的相反作用,我们在髙脂诱导的肥胖的大鼠模型和高雄的PCOS大鼠模型上进一步得到了证实。其实,除了AA,胰岛素和雄激素对其他PUFAs的代谢,如C18∶2,C20∶5和C22∶6也起相反的作用。但胰岛素和雄激素对这些活性脂质产物调节的具体分子机制尚需进一步研究。
先前有研究报道,胰岛素和胰岛素样生长因子Ⅰ(IGF-Ⅰ)经胰岛素样生长因子Ⅰ受体(IGF-ⅠR),放大白介素1β(IL-1β)诱导的COX2的表达[32]。在过敏性气道炎症的大鼠模型中,胰岛素经丝裂原活化蛋白激酶(MAPK)信号通路上调COX2和诱导型一氧化氮合成酶(iNOS)的表达[33]。肥胖和代偿性高胰岛素血症往往伴有慢性低滴度的炎症,并有IL-1β等炎症介质的升高。胰岛素是否经MAPK等信号通路,放大这些炎症因子对COX2表达的调节,需要进一步在体内外研究中证实。关于雄激素与炎症,先前通常认为在肥胖的PCOS患者中,高雄激素会加重炎症状态和代谢紊乱。然而,最近有临床研究发现,在肥胖的患者中高雄激素血症具有一定的抗炎作用[34]。我们的数据表明,OB组中AA代谢生成的一系列炎症介质高于其他各组,相反,当存在高雄激素血症时,这些产物显著下降。这些结果提示,雄激素发挥抗炎的作用,至少部分通过抑制AA代谢,减少活性脂质/炎症介质的生成。
雄激素在脂质代谢中也起重要作用。以往的研究主要集中于胆固醇及其酯、氧化低密度脂蛋白(OxLDL)和三酰甘油。此外,雄激素还增加PCOS患者内脏脂肪的脂解[13,14]。然而,在肥胖和PCOS妇女中,目前尚未见雄激素对多不饱和脂肪酸及其代谢谱影响的报道。由于前列腺素,尤其是PGE2、PGF2a和PGI2等在生殖中的重要作用,雄激素抑制前列腺素的生成可能参与PCOS的生殖异常。COX2及其代谢产物PGE2、PGI2、PGF2a、PGD2和15d-PGJ2等在生殖过程中发挥重要的生理作用,如卵母细胞成熟、排卵、受精、胚胎早期发育、着床和分娩等[15,16,17,18,19,20,21,22,23]。然而,雄激素对COX2的表达和活性的影响仍有争议。Yazawa等[35]发现,双氢睾酮(DHT)诱导正常大鼠颗粒细胞及KGN细胞中COX2基因的表达。另有研究发现,在非炎症状态下DHT通过雄激素受体(AR)依赖的机制上调COX2的表达,而在细胞因子或LPS诱导的炎症状态下,通过非AR依赖的途径下调COX2的表达[36,37]。因此,DHT对COX2表达的调节,视细胞所处的环境而选择不同的调控方式[36]。如果卵泡处于一个炎症的微环境中,升高的雄激素可能通过非AR依赖的信号通路抑制COX2的表达,导致LH诱导的PGs水平下降,最终导致PCOS患者自发排卵障碍。这也为高雄激素血症导致的排卵障碍提供了一个全新的可能的机制。
虽然本研究发现了一系列有价值的结果,但存在样本小、缺乏分子机制等不足。此外,由于是观察性研究,不能证明变化之间的因果关系。希望通过我们的初步研究,为后续的工作提供有价值的线索。
总之,在本研究中,我们发现肥胖的PCOS患者存在PC/LPC代谢异常,并伴有游离脂肪酸谱的改变。肥胖及其相伴的高胰岛素血症,促进AA代谢,而雄激素则起抑制作用,进而导致PGs水平的变化,最终参与炎症和生殖功能紊乱的发生发展。在现有脂质代谢组学的基础上,进一步采用基因组学和蛋白质组学等手段,能更好地发现、完善PCOS的发病机制,并提供新的干预策略。
分析初诊的不同表型多囊卵巢综合征(PCOS)患者血清脂质谱的变化,探究高胰岛素血症与高雄激素血症在其中所起的不同作用。
收集初诊PCOS患者32例,同时选择年龄和体质指数(BMI)匹配的正常育龄妇女34例作为对照,采集病史、体检和血标本,测常规生化和激素水平,利用液相和气相色谱联用质谱(LC-MS和GC-MS)测定血清脂质谱和多不饱和脂肪酸代谢产物的水平。
(1)肥胖的PCOS患者存在磷脂酰胆碱(PC)/溶血磷脂酰胆碱(LPC)代谢异常:PC(16∶0,18∶0,18∶1,18∶2,20∶4)升高,LPC(16∶0,18∶0,18∶1)下降(均P<0.05);(2)多不饱和脂肪酸(PUFA)显著下降,长链饱和脂肪酸升高;(3)通过测定PUFA代谢及其代谢产物水平,发现胰岛素促进PUFAs的代谢,而雄激素则起抑制作用。
PCOS患者存在磷脂、游离脂肪酸及多不饱和脂肪酸代谢的异常;胰岛素可能参与促进PUFAs的代谢,雄激素可能在其中发挥抑制作用。